Nylig lanserte FDA de endelige retningslinjene for oppføring av kosmetiske fasiliteter og produkter, og lanserte en ny kosmetikkportal kalt 'Cosmetic Direct'. Og FDA kunngjorde obligatoriske krav for registrering av kosmetiske anlegg og produktoppføring fra 1. juli 2024, for å sikre at regulerte virksomheter har tilstrekkelig tid til å forberede og sende inn informasjon.
1. Forskrifter
1)Modernization of Cosmetics Regulation Act of 2022, (MoCRA)
2)Federal Food, Drug and Cosmetic Act (FD&C Act)
3) Fair Packaging and Labeling Act (FPLA)
2. Anvendelsesområde
I henhold til amerikansk lov er kosmetikk definert som gjenstander som påføres, spres, sprayes eller på annen måte brukes på menneskekroppen for å rengjøre, forskjønne, forbedre attraktiviteten eller endre utseende.
Spesifikt inkluderer det hudfuktighetskrem, parfyme, leppestift, neglelakk, øye- og ansiktskosmetikk, rensesjampo, perm, hårfarge og deodorant, samt alle stoffer som brukes som en kosmetisk ingrediens. Såpe tilhører ikke kosmetikk.
3. Klassifisering
I følge MoCRA klassifiserer den amerikanske kosmetiske FDA kosmetikk i følgende kategorier:
-Babyprodukter: inkludert babysjampo, hudpleie talkum, ansiktskrem, olje og væske.
-Badeprodukter: inkludert badesalt, olje, medisin, skummiddel, badegel, etc.
- Øyekosmetikk: som øyenbrynsblyant, eyeliner, øyenskygge, øyeskyll, øyesminkefjerner, øyesvart, etc.
Kosmetikk med spesialeffekter, som anti-rynke, bleking, vekttap osv., må samtidig registreres som reseptfrie legemidler. Det skal bemerkes at disse nye forskriftene gjelder for kosmetikk som eksporteres til det amerikanske markedet.
FDA-registrering
MoCRA har ikke bare lagt til følgende nye krav, inkludert etablering av systemet for kosmetikkansvarlig, obligatorisk rapportering av alvorlige bivirkninger, overholdelse av Good Manufacturing Practice (GMP), registrering av fabrikkanlegg og registrering av produktoppføringer, gir tilstrekkelige sikkerhetssertifikater, men krevde også at etiketten skulle være merket med informasjon om ansvarlig person, essensallergener, profesjonell bruk av produkterklæringer, utvikling og frigjøring av asbestdeteksjonsmetoder i kosmetikk som inneholder talkum, og sikkerhetsrisikovurderingen og dyreutfasingstesten av PFAS i kosmetikk.
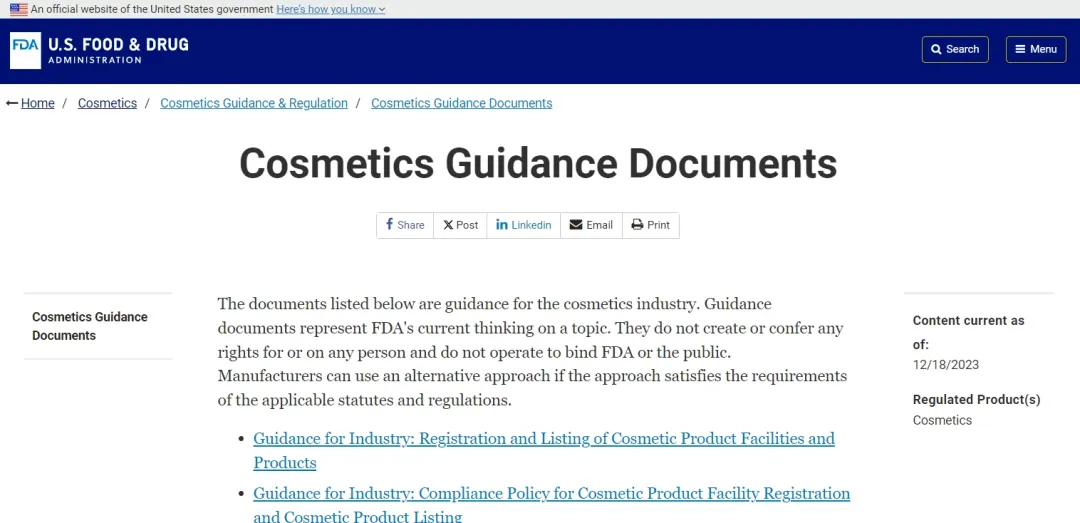
Før implementeringen av MOCRA kan kosmetikkprodusenter/-pakkere registrere sine fabrikkanlegg hos FDA gjennom US FDAs Voluntary Cosmetic Registration Program (VCRP), og FDA har ikke obligatoriske krav til dette.
Men med implementeringen av MOCRA og den kommende obligatoriske fristen, må alle selskaper som selger kosmetikk i USA registrere sine produksjonsanlegg hos FDA og oppdatere registreringsinformasjonen hvert annet år, inkludert navn, kontaktinformasjon osv. Fasiliteter som ligger utenfor USA Stater er også pålagt å oppgi informasjon og kontaktdetaljer for agenter i USA. Det er også noen tilleggsopplysninger som må fylles ut, slik som morselskapsinformasjon, bedriftstype, emballasjebilder, produktnettsidelenker, om det er en profesjonell kosmetikk, ansvarlig persons Dun&Bradstreet-kode osv. Det er ikke obligatorisk å fylle ut i. Eksisterende kosmetiske anlegg må registreres hos FDA innen ett år etter at de nye forskriftene er utstedt, og registreringsperioden for nye kosmetiske anlegg er innen 60 dager etter at de har brukt kosmetikk foredling og produksjon.
BTF Testing Lab, vårt firma har laboratorier for elektromagnetisk kompatibilitet, sikkerhetsforskrifter Laboratorium, trådløst radiofrekvenslaboratorium, batterilaboratorium, kjemisk laboratorium, SAR Laboratory, HAC Laboratory, etc. Vi har oppnådd kvalifikasjoner og autorisasjoner som CMA, CNAS, CPSC, VCCI, osv. Vårt firma har et erfarent og profesjonelt teknisk ingeniørteam, som kan hjelpe bedrifter med å løse problemet. Hvis du har relevante test- og sertifiseringsbehov, kan du kontakte vårt testpersonale direkte for å få detaljerte pristilbud og syklusinformasjon!

FDA testrapport
Innleggstid: 21. august 2024